 Por Rocío Latorre
Por Rocío LatorreJanssen pedirá al ISP autorizar uso de su vacuna en Chile y gobierno amplía negociaciones para comprar a más laboratorios
En las próximas dos semanas, Janssen -que ha comprometido cuatro millones de dosis a las autoridades- recurrirá al Instituto de Salud Pública (ISP) para obtener el permiso de emergencia, apostando a convertirse en la cuarta vacuna autorizada en el país. En paralelo, Chile sostiene conversaciones avanzadas con el Instituto Gamaleya (Sputnik V) y las otras dos vacunas de China: Sinopharm y CanSino.
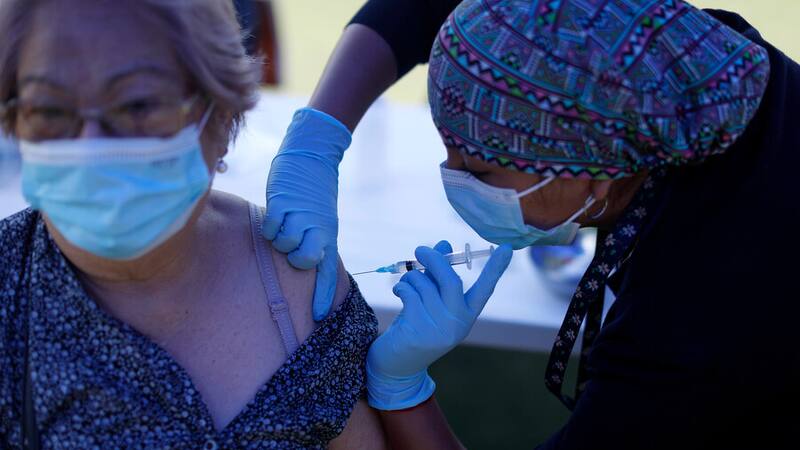
Superada la barrera de un millón de vacunados -con una o dos dosis- a menos de una semana de iniciado el proceso masivo de vacunación en el país, no son pocos los países que miran con atención cómo se está llevando a cabo la logística de la inmunización en el país. Incluso, el ministro de Salud, Enrique Paris, expuso el martes en la mañana a sus pares del Foro para el Progreso de América del Sur (Prosur) el plan de vacunación de Chile.
Sin embargo, Paris recalcó un punto clave: la disponibilidad de suministro de dosis. Sin ese punto resuelto, “no hay plan”, admitió ante los presentes.
En ese sentido, a las tres vacunas ya aprobadas por el Instituto de Salud Pública (ISP) -que cuentan con convenios de compra o preacuerdos con el país- se sumará en las próximas dos semanas la vacuna contra el Covid-19 del laboratorio Janssen (de Johnson & Johnson), quienes en paralelo al análisis que realizará el regulador farmacéutico estadounidense (FDA) el 26 de febrero para su aprobación de emergencia, ingresarán los antecedentes para que el ISP convoque a su consejo asesor dentro de esa misma semana.
“Como compañía, la semana pasada solicitamos la autorización de uso de emergencia a la FDA en Estados Unidos, y compartiremos estos datos con las autoridades regulatorias de todo el mundo. Planearemos la presentación de solicitudes de aprobación basadas en estos resultados. En el caso de Chile, estamos llevando adelante el proceso ante el ISP para obtener la autorización de uso de emergencia en el país”, confirma Paula Barreyro, directora de asuntos médicos y regulatorios para Janssen Latinoamérica.
Con Chile, la farmacéutica tiene un acuerdo para despachar cuatro millones de dosis con la particularidad -a diferencia de las otras tres vacunas ya autorizadas por el ISP, Pfizer, Sinovac y AstraZeneca-, que su esquema posológico es de una sola dosis.
Por el lado del ISP, Juan Roldán, jefe (S) de la Agencia Nacional de Medicamentos (Anamed), destaca que “Janssen es una de las vacunas que tiene estudios clínicos acá en Chile y ya hemos tenido la oportunidad de analizar antecedentes preliminares de esa vacuna. Por lo tanto, sí, estamos al tanto que próximamente van a presentar la solicitud para la autorización de la vacuna, que sería en un marco parecido a las autorizaciones anteriores: provisional, en contexto de emergencia, incluida la transparencia del proceso. La efectividad de Janssen está en un rango aceptable para combatir el Covid-19, hasta donde sabemos es que llegaría al 66%”.
Tal como señala Roldán, la Facultad de Medicina de la Universidad de Chile ha sido una de las instituciones que lideran el estudio clínico de Johnson & Johnson. El investigador principal, el infectólogo Miguel O’Ryan, detalla que los efectos adversos en los estudios a la vacuna de Janssen a nivel mundial “han sido pocos, lo que es una buena noticia. Y los efectos en nuestro estudio no han pasado de ser leves o moderadas molestias, decaimientos, fiebres. La vacuna ha sido muy bien tolerada. La eficacia contra las infecciones severas con una dosis superaba el 80%, no había casos de fallecidos a nivel mundial”.
Desde Salud, el ministro Paris asevera que “es una noticia que nos alegra mucho, pues con ello tenemos contrato”.
Conversaciones con nuevos laboratorios
Quienes conocen las tratativas con los laboratorios internacionales señalan que la estrategia de “multicompra” de vacunas por parte de Chile tiene que ver con dos incertidumbres: si se apostaba por uno o dos laboratorios, el riesgo de incumplimientos en los plazos en las entregas era alto. De hecho, ya sucedió con Pfizer BioNTech, quienes después de un mes retomarán sus envíos al país el próximo 15 de febrero. Y por otro lado, aún no existe una noción clara si la vacunación contra el Covid-19 será año a año, o por una sola única vez.
Como sea, con cuatro laboratorios con convenios vigentes, se espera sumar más en las próximas semanas. Uno de ellos es el instituto ruso Gamaleya, que cuenta con vacuna Sputnik V, la que ha reportado un 92% de efectividad.
Si bien durante la tarde de ayer se señaló que existía un acuerdo, Paris lo descarta. Sí existen conversaciones avanzadas, confirma, donde han manifestado su disponibilidad a entregar todos los antecedentes a las autoridades chilenas.
El subsecretario de Relaciones Económicas de la Cancillería, Rodrigo Yáñez, señala que “la estrategia nuestra ha sido de diversificar el suministro, y ahí lo que manda es la ciencia: no hemos dado la espalda a ninguna vacuna de ningún país, porque lo que manda es la salud de los chilenos”.
Requisitos para la Sputnik V
Personeros de RR.EE. ya han tomado contacto con el Russian Direct Investment Fund y hay dos nudos por resolver -detallan- antes de celebrar un posible acuerdo de importación: que la vacuna Sputnik V presente y obtenga la autorización de la Agencia Europa del Medicamento (EMA) -hasta ahora, la agencia reguladora reportó que no se ha ingresado dicha solicitud-, y que además aseguren niveles de producción suficientes para cubrir las dosis con las que se comprometerían. En este último punto, los negociadores chilenos confirman que les han comentado que Rusia está buscando aumentar la producción de vacunas en Corea del Sur.
De cumplirse estos requerimientos, las dosis podrían estar llegando a Chile durante el primer semestre y posiblemente en abril
A esas conversaciones se suman las gestiones para obtener la vacuna de Sinopharm y de CanSino. Esta última, del laboratorio chino-canadiense, cuenta con representación en Chile a través del laboratorio Saval, además de ya haber finalizado los estudios clínicos que se estaban llevando a cabo en la Universidad de la Frontera en Temuco. “Es una alternativa que estamos explorando hacia el segundo semestre”, afirman en el gobierno.
En el caso de Sinopharm -quienes distribuyeron el primer cargamento de 300.000 mil dosis en Perú- hasta hace unos días existía una “restricción de importación” desde China a otros países, puesto que el medicamento aún no contaba con la aprobación comercial, lo que limitaba la cantidad de vacunas que podían salir del país. Sin embargo, esa situación ya habría sido subsanada, por lo que personeros diplomáticos de Chile han reactivado dichas conversaciones.
Pfizer reanuda sus envíos tras controversia
Con Pfizer las gestiones tras el acuerdo han sido distintas. Con un contrato ya consignado por 10,1 millones de dosis para el 2021, el nudo que ha debido resolver Cancillería ha sido el cumplimiento de las fechas estipuladas tras el cese de envíos durante casi un mes a Chile, debido a las presiones de la Unión Europea (UE) y Estados Unidos por mantener las dosis en sus territorios para asegurar la cobertura.
Se hicieron gestiones diplomáticas y políticas “del más alto nivel”, relata un personero de gobierno. Y una de ellas fue una conversación directamente con el comisario de Comercio de la UE, Valdis Dombrovskis, para así asegurar que el laboratorio cumpla, sin presiones de los países, con el envío de 1.350.000 dosis antes del 30 de marzo para Chile. Hasta ahora, Pfizer se ha comprometido y a partir de mediados de febrero en adelante, los envíos deberán ser de una periodicidad una vez por semana -o incluso hasta dos- para cumplir con dicha meta.
COMENTARIOS
Para comentar este artículo debes ser suscriptor.
Lo Último
Lo más leído
3.
4.


















