 Por Ricardo Olave
Por Ricardo OlaveCientífico chileno avanza en terapias para niños que padecen la enfermedad de Duchenne
Enrique Brandan ha dedicado gran parte de su carrera a estudiar el comportamiento de las distrofias musculares, entre ellas, la enfermedad de Duchenne, un trastorno genético progresivo que ataca los músculos de los niños. Si bien no existe una cura, diversas investigaciones lideradas por el académico de la U. San Sebastián, asociado a la Fundación Ciencia & Vida, han dado con respuestas paliativas efectivas, desde antiinflamatorios vegetales hasta la inhibición de una proteína causante del padecimiento, que están siendo probadas por la autoridad sanitaria de Estados Unidos.

Cuando Josefina García Huidobro escuchó por teléfono el diagnóstico de su hijo Pedro Bordalí, sintió que el techo caía sobre su cuerpo. Ella sabía perfectamente lo que era la Distrofia Muscular de Duchenne (DMD), dado que su hermano menor había padecido lo mismo. Una enfermedad compleja y sin cura solo presente en niños, que limita su independencia y calidad de vida.
No fue fácil asumir la realidad. Pasaron tres años hasta saber el diagnóstico de Pedro. En el jardín, notaron que tenía problemas motores, que no jugaba con otros niños. Ella nunca lo percibió, al tener cuatro hijos en casa. Sin embargo, al saber el resultado, recordó todas las etapas de la enfermedad que vivió su familiar, hasta su muerte a los 25 años. Decidió que, a pesar del resultado, su lucha sería encontrar las mejores posibilidades para que su hijo pudiera extender su vida.
Existen entre tres mil y cinco mil distrofias distintas, un concepto que habla de debilidad muscular. Entre todas ellas está la denominada Enfermedad de Duchenne. Aunque está clasificada como una enfermedad rara, al menos uno de cada 3.500 hombres que nacen pueden contraer el síndrome. En general, sólo los varones pueden desarrollarla, siendo las mujeres quienes portan la mutación. Hablar de Duchenne es complejo, ya que ataca a un grupo en particular que no es consciente del destino que les depara: un diagnóstico dramático para la mayoría de las familias que desconocen sus consecuencias.
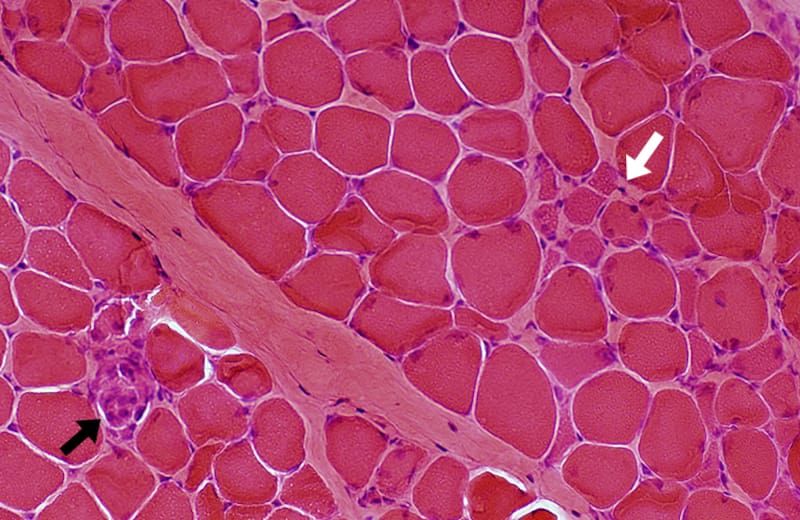
Cuando existe distrofia muscular, ocurre continuamente la muerte de las fibras musculares, que son las responsables de ejercer la fuerza muscular. En esta enfermedad, en particular, no se expresa una proteína esencial del músculo, que se llama “distrofina”, y su ausencia produce una continua muerte del tejido muscular.
El biólogo e investigador de la U. San Sebastián (USS) y Fundación Ciencia & Vida, Dr. Enrique Brandan, ejemplifica con el caso de un deportista: “Si se desgarra, también ocurre muerte de la fibra, pero el cuerpo humano tiene células que permiten regenerar ese daño gracias a las células satélites, que son una especie de reservorio para formar nuevo músculo en caso de que se dañe”.

El músculo, al igual que otros tejidos, tiene capacidad de regenerarse frente al daño. El cuerpo humano posee alrededor de 660 músculos distintos, los que son vitales para poder desplazarse, comer o incluso hablar, siempre que estén en óptimo funcionamiento. Pero en una persona con distrofia, al no existir dicha proteína, el fenómeno de degeneración/regeneración del tejido agota esas células satélites, provocando que no se regenere el tejido y que sea invadido por tejidos conectivos e inflamatorios, fenómeno llamado fibrosis.
Enrique Brandan es especialista en el tema. Comenzó a investigar distrofias a mediados de los años 90, misma década en que Josefina García Huidobro tuvo a su hijo. En ese entonces, su campo de especialidad eran los músculos y su formación, sus procesos de diferenciación celular. Tenía un interés particular en cómo la célula “conversaba” con la matriz extracelular, y cómo esto era en parte responsable de la contracción del músculo.
Asistiendo a variadas reuniones científicas, el Dr. Brandan comenzó a notar que, el 95 por ciento del tiempo se hablaba de modelos genéticos. Siempre al final de dichos encuentros existía una pequeña sesión de profesionales que hablaban de las distrofias y de biomedicina. Al observar las imágenes, comenzaron a aparecer una serie de dudas, que el Dr. Brandan decidió responder en su laboratorio. Ahí fue cuando se interesó en la fibrosis muscular, de la cual, en ese entonces, se sabía muy poco.
Mejor calidad de vida
Comúnmente, el camino de un niño con Duchenne es conocido. Desde los 12 a 14 años, los afectados solo pueden desplazarse en silla de ruedas. Luego, de los 14 a 18, algunos de ellos tendrán problemas respiratorios y deberán someterse a una traqueotomía, junto con contar con ayuda la respiración. Desde entonces, deberán mejorar las condiciones para que pueda movilizarse a las terapias, una serie de costos indirectos que afectan no solo a quien padece la enfermedad, sino que a la familia que debe adaptarse a la dependencia del afectado.
Para encontrar soluciones, se necesita investigación básica. Enrique Brandan, en su carrera académica ha liderado sobre una veintena de tesis de doctorado e investigaciones de laboratorio, que han dado interesantes pasos para acercarse a un mejor y completo tratamiento. “Hay avances científicos en modelos animales que probablemente podrían aumentar el promedio de vida”, asegura el académico USS.
Resaltan sus trabajos con moléculas antiinflamatorias de origen vegetal en pacientes con distrofia muscular de Duchenne. “Cuando mirábamos estas imágenes en laboratorio, la solución definitiva a esta enfermedad es arreglar la proteína mala, la distrofina. Pero es una proteína tremendamente grande y compleja”, detalla, y explica: “No es posible tratar todos los músculos afectados. Como la proteína es extremadamente grande, técnicamente resulta muy difícil realizar una terapia genética”.
Por ello, el especialista y su equipo pensaron en un potente antiinflamatorio para enfrentar la reacción inflamatoria que conlleva la muerte de las fibras. El sistema inmune, cuando ve células muertas, se come los restos. Al estar continuamente rompiéndose las fibras en los pacientes, estos sufren siempre de inflamación elevada y constante. Si se disminuye la inflamación -pensó- va a mejorar la fuerza muscular. “No vamos a encontrar una cura definitiva, pero habrá mejor calidad de vida para los pacientes”, señala sobre el potente analgésico desarrollado en Chile.
En tanto que la segunda aproximación a un tratamiento está entregando señales positivas. El Dr. Brandan investigó en modelos animales el factor “CTGF”, sigla en inglés que indica “factor de crecimiento de tejido conectivo”, un elemento clave para enfrentar la fibrosis asociada a los casos de Duchenne.

En el año 2000 comenzó a suponer, sin pruebas en ese entonces, que ese factor podría estar involucrado en la distrofia. Participando en conferencias, comenzó a estudiar la proteína, para luego dirigir tesis con modelos animales, en las que buscaba comprobar qué pasaría si se inhibe el CTGF, dando como resultado menos fibrosis, lo que presentaría una mejoría en la fuerza muscular.
¿Cómo se puede inhibir el CTGF? El especialista decidió seguir el camino de la genética. Probaron la teoría con modelos preclínicos, dando buenos resultados. Sin embargo, ese trabajo académico no se puede llevar a humanos directamente. Fue así como, buscando potenciales formas de extender la investigación a casos humanos, descubrió la existencia de FibroGen, una empresa biofarmacéutica norteamericana que cuenta con anticuerpos contra el CTGF, la pieza que necesitaba.
Tras un año de insistencia, el Dr. Brandan dio un seminario explicando sus avances a ejecutivos y científicos de la compañía norteamericana. No obstante, FibroGen no demostraba interés en apoyar la investigación, dada la rareza de Duchenne. “Les interesaba fibrosis hepática, pulmonar o renal, casos por los que mueren muchas personas”, manifiesta, posición que no le impidió seguir insistiendo.
Pero llegó su momento cuando la Food and Drug Administration (FDA), la agencia del Gobierno de los Estados Unidos responsable de la regulación de los medicamentos, cambió la legislación facilitando el desarrollo de los estudios de enfermedades raras, para hacer más rápido y expedito el licenciamiento de potenciales drogas. Así, FibroGen le abrió la puerta al laboratorio de Enrique Brandan. Él les contó de los modelos, los experimentos realizados en Chile, hasta convencerlos de que le facilitaran los anticuerpos para inhibir CTGF y para seguir investigando.

Así, se desarrollaron nuevas tesis, que tuvo a ratones con Duchenne que fueron inyectados con anticuerpos CTGF durante ocho semanas, analizando la fuerza de los animales. El trabajo comprobó que el músculo mejora, la fibrosis disminuye y los animales tienen más fuerza. “La inhibición genética o farmacológica permiten un cambio que se nota”, precisa el científico.
La compañía se entusiasmó con lo comprobado, avanzando en diversas fases de investigación en pacientes. El Dr. Brandan es uno de los autores de la patente del uso anticuerpos anti CTGF en distrofias musculares, trabajo realizado en Chile en los laboratorios de la Universidad Católica de Chile. Esta es una de las cuatro patentes que el investigador tiene registrada a su nombre tanto en Estados Unidos como en Europa.
En octubre de 2020, la terapia basada en los hallazgos chilenos contra la distrofia muscular llegó a la fase 2 en Estados Unidos, con un mayor número de pacientes no ambulatorios para probar lo creado, descubriendo resultados promisorios, como la mejora de la fuerza muscular, mayor capacidad pulmonar y cardiovascular. En la actualidad están en curso estudios en fase 3 en pacientes ambulatorios y no ambulatorios con la enfermedad de Duchenne. El músculo que más se afecta en la distrofia de Duchenne es el diafragma, al estar contrayéndose constantemente, siendo una de las razones por las que fallecen quienes sufren la enfermedad por problemas cardiorrespiratorios. Prontamente, se deberían entregar resultados finales a través de la página web oficial de la FDA.
Conexión humana
A veces pasa desapercibida la importancia de la ciencia básica en el avance de posibles tratamientos biomédicos. El trabajo del laboratorio es silencioso, ya que cada cierto tiempo entrega luces de los avances. Frente a su trabajo como científico, Enrique Brandan plantea: “Para mí fue un camino obvio; en mi caso tuve un poco de suerte de darme cuenta y combatir la fibrosis desde la ciencia”.
En su época de estudiante, cuando ingresó a estudiar biología a principios de la década de los 70, no existían ofertas que permitieran conectar los avances con productos biomédicos en el país. “Los científicos aprenden cómo funcionan las cosas, pero con el desarrollo del conocimiento, estos productos se han ido trasladando a los pacientes”, asegura.
Actualmente, forma parte del claustro académico en los programas de doctorado en Biotecnología y Bioemprendimiento y en Biología Celular y Biomedicina de la Universidad San Sebastián, que forman investigadores para entender el origen de las enfermedades y contribuir al desarrollo de nuevo conocimiento para la búsqueda de nuevas alternativas de tratamiento.
Paralelamente, apoya a padres y comunidades que comparten con pacientes afectados con Duchenne, dando charlas en la Fundación Duchenne Chile, creada en 2016 por iniciativa de Jessica Pérez, cuyo hijo falleció de esta enfermedad.
El Dr. Brandan cree necesario acercar el conocimiento a quienes deben convivir con este complejo del diagnóstico, para que las familias puedan saber que sus hijos pueden conseguir una mejor calidad de vida a través de la medicina. “No estamos diciendo que harán una vida 100 por ciento independiente, pero para una familia que sufre Duchenne es un cambio importante. Cualquier distrofia, en particular Duchenne, tiene un impacto tremendo”, recalca.

Las charlas que ha realizado sobre Duchenne se han transformado, en sus palabras, en un aspecto gratificante de su carrera universitaria. Él agrega: “Fui a diferentes comunas que yo no conocía. Esta enfermedad afecta a todos, y yo pude ver el Chile real. Me sacó de una burbuja intelectual y pude hablar con gente, hacerles ver a los apoderados y profesores que esa sala de clases era un problema, una serie de detalles que afectan a un niño con debilidad muscular”.
Con una sensibilidad diferente a quien investiga sin conocer el campo que estudia, el Dr. Enrique Brandan y su equipo se han involucrado, cambiando la forma en cómo trabajan en el laboratorio, demostrando que su investigación puede cambiar vidas.
Josefina García Huidobro, cofundadora de Duchenne Chile, valora el rol que ha tomado el investigador USS en la fundación, siendo su trabajo una esperanza para que aparezcan otros médicos o científicos que tomen la iniciativa de investigar sobre estas enfermedades.
Hoy, con 26 años, Pedro Bordalí es un adulto joven con una expectativa de vida mucho mayor de la que esperaron. Su madre reconoce que cuenta con los medios para poder tratarlo, mas hay muchos padres a lo largo de Chile y el mundo que no cuentan con todas las herramientas para enfrentarla, pues esta enfermedad no tiene cobertura especial en el país, ni tampoco existen cifras sobre cuántas personas lo padecen.
García Huidobro ha acompañado hasta estos días el desarrollo de su hijo, quien tras terminar cuarto medio descubrió su interés por la pintura. En compañía de un arteterapeuta, Pedro ha desarrollado su camino en el arte: ha expuesto sus obras y ha vendido sus cuadros en una sala de Lo Barnechea en octubre de 2019. Ocho meses de trabajo en los que retrató rostros de personas de distintas edades, dando cuenta de una entrega genuina frente a una pasión. A pesar de los problemas, Pedro sigue los objetivos que se ha propuesto.

El ímpetu de Pedro lo llevó a realizar videos en TikTok, donde ha logrado hasta 175 mil visualizaciones contando su lucha para enfrentar la distrofia muscular Duchenne. “Quiero darle ánimo a las personas que tienen la misma enfermedad, para ayudarles a ver la vida en colores”, afirma.
COMENTARIOS
Para comentar este artículo debes ser suscriptor.
Lo Último
Lo más leído
2.
4.
¿Vas a seguir leyendo a medias?
Todo el contenido, sin restriccionesNUEVO PLAN DIGITAL $1.990/mes SUSCRÍBETE


















