
Laboratorio chileno describe nuevo tipo de dolor asociado al Parkinson
La investigación, podría contribuir a definir blancos terapéuticos en las fases iniciales del desarrollo de una enfermedad que afecta a 40 mil chilenos y chilenas, y cuya prevalencia mundial se ha duplicado en los últimos 25 años.

El dolor neuropático, identificado como uno de los primeros signos de la enfermedad de Parkinson, ha sido objeto de múltiples estudios. Sin embargo, hasta ahora no se comprendía el mecanismo biológico que lo desencadena, lo que representa un desafío en el abordaje clínico de la enfermedad.
A diferencia de los síntomas motores típicos, como temblores, rigidez y dificultades de movimiento, este tipo de dolor afecta el sistema nervioso periférico. En Chile, hasta 40 mil personas podrían vivir con este trastorno, según datos del Ministerio de Salud, lo que evidencia su relevancia en la salud pública nacional.
Según la Organización Mundial de la Salud (OMS), el Parkinson ha visto duplicada su prevalencia en los últimos 25 años, y la mortalidad asociada a esta patología ha crecido de manera significativa. En 2016 se reportaron más de 211 mil muertes, cifra que aumentó a 329 mil para 2019, evidenciando la necesidad de nuevos enfoques terapéuticos.
Laboratorio chileno describe nuevo tipo de dolor asociado al párkinson
Investigadores del laboratorio de Neuroinmunología del Centro Basal Ciencia & Vida de la Universidad San Sebastián han formulado un hallazgo relevante sobre el dolor neuropático en el Parkinson. Observado en modelos preclínicos, este avance —próximo a ser publicado— podría abrir la puerta a nuevas estrategias terapéuticas enfocadas en los síntomas tempranos de la enfermedad.
La Dra. Zulmary Manjarres, responsable del estudio, explicó que este tipo de dolor, considerado un síntoma “no motor”, suele aparecer hasta una década antes del diagnóstico formal. “La gente no suele asociar párkinson con dolor, pero seis de cada diez pacientes lo han experimentado”, detalla, precisando que el dolor neuropático se diferencia del asociado a la rigidez muscular y los temblores, pues surge por daño en el sistema nervioso periférico.
En las fases iniciales, el sistema inmune adaptativo y la microbiota juegan un papel determinante en la aparición del dolor neuropático. “Ambos actores son necesarios para que este síntoma se manifieste en las etapas iniciales de la enfermedad”, afirma Manjarres. Los linfocitos T, particularmente los TCD4 y TCD8, desempeñan un papel central en esta interacción, al ser responsables de una parte clave de la respuesta inmune prolongada.
El modelo experimental utilizado en el estudio se basó en la sobreexpresión de la proteína alfa-sinucleína, una molécula que, al acumularse de manera anormal, está vinculada a la formación de cúmulos patológicos llamados “Cuerpos de Lewy”. El experimento también permitió reproducir de forma temprana trastornos en la función intestinal, incluso antes de la aparición de los temblores, reflejando con precisión el desarrollo inicial de la enfermedad.
El estudio reveló nuevos hallazgos sobre cómo la microbiota intestinal podría estar involucrada en la regulación del dolor crónico en pacientes con Parkinson. Según la revisión, este conjunto de microorganismos influye directamente en las neuronas sensoriales del intestino o de forma indirecta al activar respuestas inflamatorias en el sistema inmune.
“La enfermedad de Parkinson no solo implica un deterioro motor, sino también sintomatología no motora, incluido el dolor crónico”, explica el Dr. Rodrigo Pacheco, director del estudio y receptor de fondos internacionales como los de la Michael J. Fox Foundation. Este trabajo reafirma la importancia de los procesos fuera del cerebro en las primeras fases de la enfermedad.
La Dra. Zulmary Manjarres, parte del equipo investigador, destaca que en la última década la microbiota ha emergido como una opción terapéutica prometedora. “Estaríamos viendo elementos que podrían potenciar el síndrome muy tempranamente, incluso antes de los eventos visibles en el sistema nervioso central”, señaló.
Estos hallazgos podrían abrir una ventana crucial para la intervención temprana, ya que el daño comienza antes de que los síntomas motores se hagan evidentes. “La interacción entre la microbiota y el sistema inmune podría permitir identificar blancos terapéuticos en etapas donde aún es posible cambiar el curso del síndrome”, añade Manjarres.
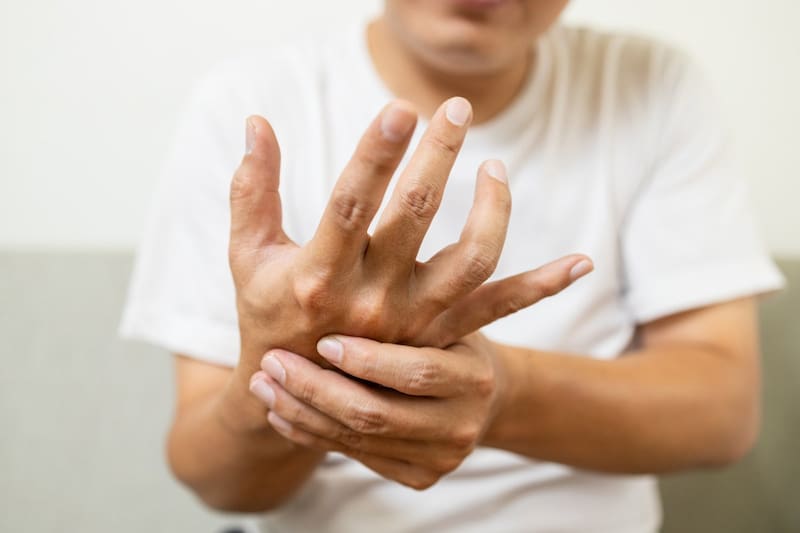
El estudio también evidenció que los linfocitos del sistema inmune juegan un papel central en esta interacción. “Nos propusimos entender cómo esta ‘conversación’ entre la microbiota y los linfocitos del sistema inmune genera daño temprano. Y pudimos demostrar esta conexión”, explica la investigadora.
Los modelos experimentales revelaron que la acumulación anómala de la proteína alfa-sinucleína en las fibras nerviosas es un factor clave en el desarrollo del daño. Sin embargo, aún no se ha establecido si esta acumulación es causa o consecuencia del proceso patológico.
En conclusión, se observó que las neuronas sensoriales periféricas se encontraban “hiperexcitables”, es decir, más reactivas a los estímulos. “Pudimos establecer una relación causal entre esta hiperexcitabilidad y la interacción entre la microbiota y los linfocitos del sistema inmune”, concluye Manjarres.
Ensayos de 32 semanas
La Dra. Zulmary Manjarres explica que, aunque aún no se comprende completamente por qué la proteína alfa-sinucleína se vuelve patogénica, el sistema inmunitario podría estar involucrado en este proceso. Para comprobarlo, los investigadores realizaron pruebas en un modelo preclínico bajo dos condiciones: ausencia de linfocitos T y ausencia de microbiota. En ambos casos, la eliminación de uno de estos elementos evitó el desarrollo de la patología.
“También hicimos una secuenciación del metagenoma para analizar la estructura y función de las bacterias presentes en el intestino de individuos con Parkinson, asociando esta composición de microbiota con el dolor neuropático”, comenta Manjarres. Este enfoque permitió profundizar en el papel de los microorganismos intestinales como posibles desencadenantes.
Los hallazgos del estudio se agrupan en tres áreas clave. Primero, la descripción del dolor neuropático; segundo, la confirmación de que la interacción entre el sistema inmune y la microbiota es esencial para el deterioro motor y sensorial; y tercero, la posibilidad de intervenir terapéuticamente en esta comunicación mediante compuestos bacterianos derivados del triptófano o ácidos grasos de cadena corta.
Las próximas fases de investigación buscarán manipular biotecnológicamente la microbiota. “Apuntamos a administrar un cóctel de bacterias beneficiosas que podrían frenar el progreso de la enfermedad o modular la respuesta inflamatoria, evitando así la generación patogénica de alfa-sinucleína”, establece la investigadora.

COMENTARIOS
Para comentar este artículo debes ser suscriptor.
Lo Último
Lo más leído
1.
2.
3.
5.



















