Científicos de Cambridge crean embriones sintéticos con cerebro y corazón latiendo
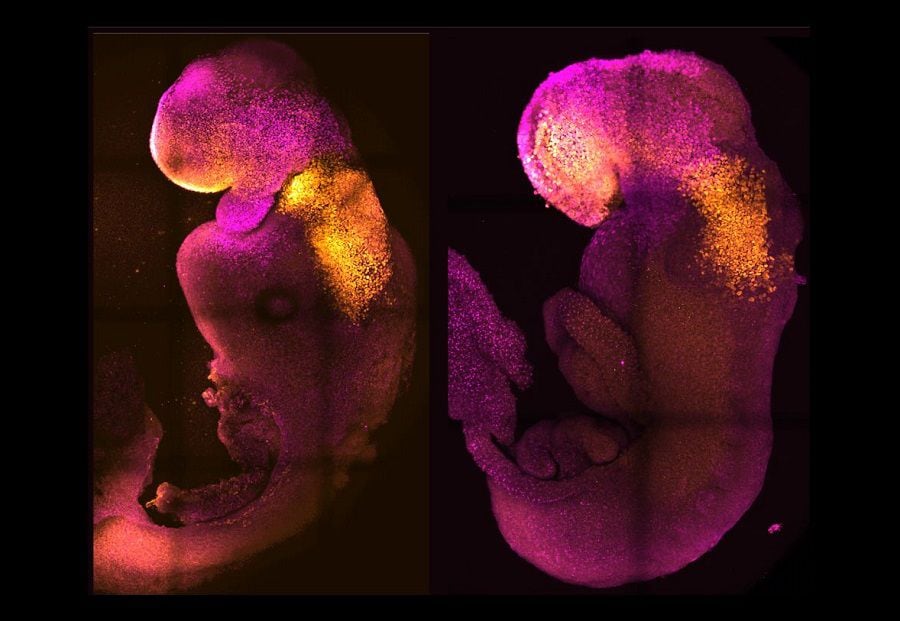
Embriones fueron desarrollados a partir de células madre de ratón, formando un cerebro y un corazón funcional, los cimientos de todos los demás órganos del cuerpo y una nueva vía para recrear las primeras etapas de la vida.
Un equipo de científicos de la U. de Cambridge, dirigido por la profesora Magdalena Zernicka-Goetz , desarrolló un modelo de embrión sin óvulos ni espermatozoides y, en su lugar, utilizó células madre, las células maestras del cuerpo, que pueden convertirse en casi cualquier tipo de célula del cuerpo.
Los investigadores imitaron los procesos naturales en el laboratorio al guiar los tres tipos de células madre que se encuentran en el desarrollo temprano de los mamíferos hasta el punto en que comienzan a interactuar. Al inducir la expresión de un conjunto particular de genes y establecer un entorno único para sus interacciones, los investigadores lograron que las células madre “hablaran” entre sí.
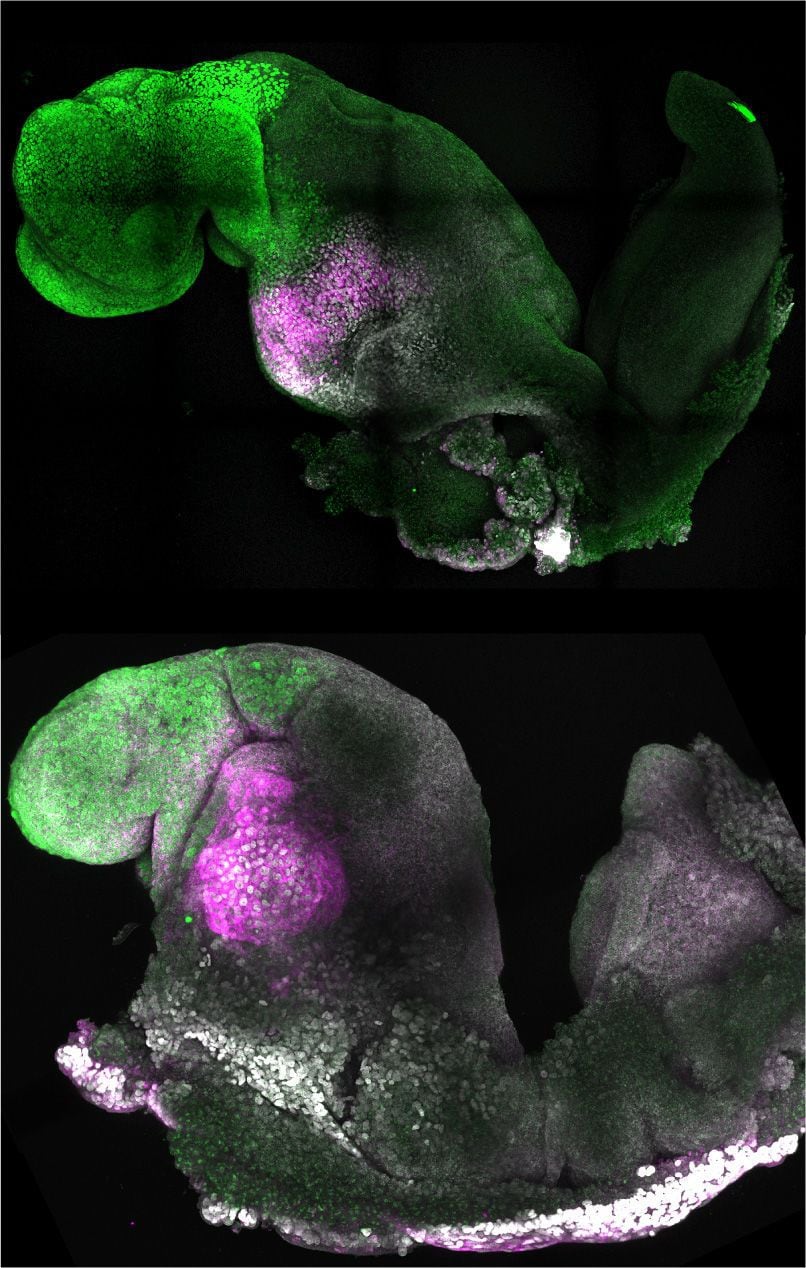
Las células madre se autoorganizaron en estructuras que progresaron a través de las sucesivas etapas de desarrollo hasta que tuvieron corazones latiendo y los cimientos del cerebro, así como el saco vitelino donde el embrión se desarrolla y obtiene nutrientes en sus primeras semanas. A diferencia de otros embriones sintéticos, los modelos desarrollados por Cambridge llegaron al punto en que todo el cerebro, incluida la parte anterior, comenzó a desarrollarse.
El equipo dice que sus resultados, resultado de más de una década de investigación que condujo progresivamente a estructuras similares a embriones cada vez más complejas y que se informaron hoy en la revista Nature, podrían ayudar a los investigadores a comprender por qué algunos embriones fallan mientras que otros se convierten en un embarazo saludable. Además, los resultados podrían usarse para guiar la reparación y el desarrollo de órganos humanos sintéticos para trasplante.
“Nuestro modelo de embrión de ratón no solo desarrolla un cerebro, sino también un corazón que late, todos los componentes que componen el cuerpo”, dijo Magdalena Zernicka-Goetz, profesora de Desarrollo de Mamíferos y Biología de células madre en el Departamento de Fisiología, Desarrollo y Neurociencia de Cambridge, en un comunicado de la universidad. “Es increíble que hayamos llegado tan lejos. Este ha sido el sueño de nuestra comunidad durante años y un enfoque importante de nuestro trabajo durante una década, y finalmente lo hemos logrado”.
Para que un embrión humano se desarrolle con éxito, debe haber un “diálogo” entre los tejidos que se convertirán en el embrión y los tejidos que conectarán el embrión con la madre. En la primera semana después de la fertilización, se desarrollan tres tipos de células madre: una eventualmente se convertirá en los tejidos del cuerpo y las otras dos apoyarán el desarrollo del embrión. Uno de estos tipos de células madre extraembrionarias se convertirá en la placenta, que conecta al feto con la madre y proporciona oxígeno y nutrientes; y el segundo es el saco vitelino, donde crece el embrión y de donde obtiene sus nutrientes en el desarrollo temprano.
Muchos embarazos fracasan en el momento en que los tres tipos de células madre comienzan a enviarse señales mecánicas y químicas entre sí, que le indican al embrión cómo desarrollarse adecuadamente.
“Muchos embarazos fracasan en esta etapa, antes de que la mayoría de las mujeres se den cuenta de que están embarazadas”, dijo Zernicka-Goetz, quien también es profesora de biología e ingeniería biológica en Caltech. “Este período es la base para todo lo demás que sigue en el embarazo. Si sale mal, el embarazo fracasará”.
Durante la última década, el grupo de la profesora Zernicka-Goetz en Cambridge ha estado estudiando estas primeras etapas del embarazo para comprender por qué algunos embarazos fracasan y otros tienen éxito.
Zernicka-Goetz agregó: “Esta accesibilidad nos permite manipular genes para comprender sus funciones de desarrollo en un sistema experimental modelo”.

Para guiar el desarrollo de su embrión sintético, los investigadores juntaron células madre cultivadas que representan cada uno de los tres tipos de tejido en las proporciones y el entorno correctos para promover su crecimiento y comunicación entre sí, y eventualmente autoensamblarse en un embrión.
Los investigadores descubrieron que las células extraembrionarias envían señales a las células embrionarias mediante señales químicas, pero también mecánicamente o mediante el tacto, guiando el desarrollo del embrión.
“Este período de la vida humana es tan misterioso, por lo que poder ver cómo sucede en un plato, tener acceso a estas células madre individuales, comprender por qué fracasan tantos embarazos y cómo podríamos evitar que eso suceda, es bastante especial”, dijo Zernicka-Goetz. “Observamos el diálogo que tiene que ocurrir entre los diferentes tipos de células madre en ese momento; mostramos cómo ocurre y cómo puede salir mal”.
Zernicka-Goetz agregó: “Esta accesibilidad nos permite manipular genes para comprender sus funciones de desarrollo en un sistema experimental modelo”.

“Hay tantas personas en todo el mundo que esperan durante años un trasplante de órganos”, dijo Zernicka-Goetz. “Lo que hace que nuestro trabajo sea tan emocionante es que el conocimiento que surge de él podría usarse para hacer crecer órganos humanos sintéticos correctos para salvar vidas que actualmente se están perdiendo. También debería ser posible afectar y curar órganos adultos utilizando el conocimiento que tenemos sobre cómo se fabrican.
Me fascina el misterio de cómo funcionan los embriones. Cada embrión sigue un viaje similar: una célula se convierte en muchas, luego se comunican entre sí y se organizan para formar una estructura que proporcionará un modelo para todas las partes del cuerpo adulto. Pero, ¿cómo deciden las células embrionarias su destino, cómo saben adónde ir y qué hacer? ¿Cómo forman las partes correctas en el lugar correcto en el momento correcto?
Construir los primeros modelos de ‘embriones sintéticos’ fue un proceso que logramos paso a paso. Al partir, sabíamos que las células madre embrionarias podían cultivarse indefinidamente en el laboratorio y que, cuando se inyectan en un embrión, pueden contribuir potencialmente a cualquier tejido del organismo adulto. El desafío era guiarlos para que se convirtieran en un embrión completo. Además de las células madre embrionarias utilizamos dos tipos de tejido extraembrionario: uno forma la placenta y el otro un saco en el que se desarrolla el embrión. Estos tejidos son muy importantes, ya que envían señales al embrión para que se desarrollen todas sus partes en el momento adecuado y en el lugar adecuado.
La combinación de células madre que representan cada uno de estos tres tipos de tejido es más fácil de decir que de hacer. Tuvimos que encontrar un entorno en el que los tres tipos distintos de células pudieran crecer y comunicarse entre sí. Y teníamos que encontrar las proporciones correctas de cada tipo de célula y agregarlas en la secuencia correcta. Una vez que establecimos estos principios básicos, las células madre hicieron el resto: se autoorganizaron para progresar a través de sucesivas etapas de desarrollo hasta que tuvieron corazones latiendo y las bases para un cerebro.
La clave de nuestro logro fue pensar fuera de la caja convencional. La mayoría de los estudios de modelos de embriones se centran en las células madre embrionarias, pero no consideran el papel importante de las células extraembrionarias. Mezclamos las proporciones adecuadas de células madre embrionarias y extraembrionarias. Las células extraembrionarias envían señales a las células embrionarias a través de diferentes medios, mediante señales químicas pero también mecánicamente ‘al tacto’. Nuestros estudios están ayudando a comprender estos eventos de señalización.
Estamos desarrollando un modelo análogo del embrión humano, para comprender los mecanismos detrás de procesos cruciales que de otro modo serían imposibles de estudiar. Esto es importante porque la gran mayoría de los embarazos humanos fallan en esta etapa de desarrollo, debido a causas que no comprendemos. También nos permitirá identificar los factores que permiten el desarrollo de tejidos humanos sanos a medida que forman diferentes órganos.

La creación del nuevo ‘embrión sintético’ nos ha enseñado mucho sobre los mecanismos por los cuales el embrión se construye a sí mismo. Aprendimos cómo los tejidos extraembrionarios dirigen las células madre embrionarias a lo largo de las vías correctas para señalar la formación de las estructuras correctas; cómo las células se mueven entre compartimentos a medida que surge el plan corporal de múltiples capas; y cómo esto establece correctamente el escenario para la neurulación, el proceso en el que el tejido se pliega para formar el tubo neural y, a su vez, el cerebro y la médula espinal.
Este modelo nos da acceso a la estructura en desarrollo en una etapa que normalmente se nos oculta, cuando el diminuto embrión se implanta en el útero de la madre. Nuestro modelo no tiene que implantarse para desarrollarse, por lo que permanece completamente visible para nosotros, permitiéndonos ver la progresión del embrión a través de esa etapa de desarrollo. Esta accesibilidad nos permite manipular los genes para comprender sus funciones de desarrollo en un sistema experimental modelo.
Ciertamente es cierto que realizar este tipo de trabajo requiere pasión y resiliencia. Crecí en Polonia bajo un régimen comunista, lo que significaba que no estaba permitido viajar y no se alentaba a pensar diferente. Había una inmensa presión social para conformarnos, y muchos de nosotros nos rebelamos contra eso. Un lado positivo de esto fue el deseo de pensar de forma independiente y perseverar a pesar del desánimo. Eso también me formó como científico.
Cuando inicié mi grupo de investigación en Cambridge, establecí formas de estudiar la ‘caja negra del desarrollo’: el desarrollo del embrión en el momento de la implantación. Mis mentores me habían disuadido de seguirlo durante mi doctorado porque les preocupaba que sería difícil sacar luz dentro de esta ‘caja’. Pero la cuestión de cómo se autoorganiza el embrión me atrapó tanto que no me rendí y, centímetro a centímetro, hemos ido avanzando.
Mi consejo para todos los jóvenes científicos es que sigan su corazón. Estudie un tema que lo inspire y elija un asesor que pueda apoyar su estilo de trabajo. En mi opinión, es importante guiar a los jóvenes científicos en el laboratorio, pero también darles espacio para explorar su individualidad. Mi experiencia es que los desafíos para las mujeres científicas aumentan a medida que avanzan en sus carreras. En etapas posteriores, es fundamental contar con mentores que entiendan no solo la ciencia, sino también cómo equilibrarla con la vida cotidiana, incluida la formación de una familia.
Durante mi propio embarazo, me sorprendió cuando una prueba de detección temprana mostró anomalías. El muestreo fue de células extraembrionarias, así que esperé a la amniocentesis, que toma muestras de células fetales que han caído en el líquido amniótico. Estos eran normales, lo que me tranquilizó. La experiencia me llevó a estudiar la aneuploidía en mosaico, una condición en la que el embrión tiene células con el número incorrecto de cromosomas junto con células cromosómicamente normales. Increíblemente, descubrimos que estas células anormales pueden eliminarse y las células normales y sanas compensan su ausencia. Por alguna razón, este mecanismo no funciona en los tejidos que forman la placenta, y todavía estamos tratando de entender por qué y cómo.
La ciencia es exigente, es un trabajo duro y te quita la mayor parte de tus horas de vigilia. Me desconecto viendo películas: veo muchas películas extranjeras en polaco, francés y danés, y documentales y películas de arte. Pero cuando quiero perderme en otra narrativa, veo dramas. ¡También soy un converso reciente a la jardinería, donde puedo fomentar el desarrollo exitoso de otras formas de vida!
Es un sentimiento increíble y un privilegio tener esta visión directa de los orígenes de una nueva vida. Es como descubrir un nuevo planeta que no sabíamos que existía.









Comenta
Por favor, inicia sesión en La Tercera para acceder a los comentarios.