EE.UU. aprueba plasma sanguíneo como tratamiento para el coronavirus, pero la OMS tiene dudas y dice que la evidencia es de “baja calidad”
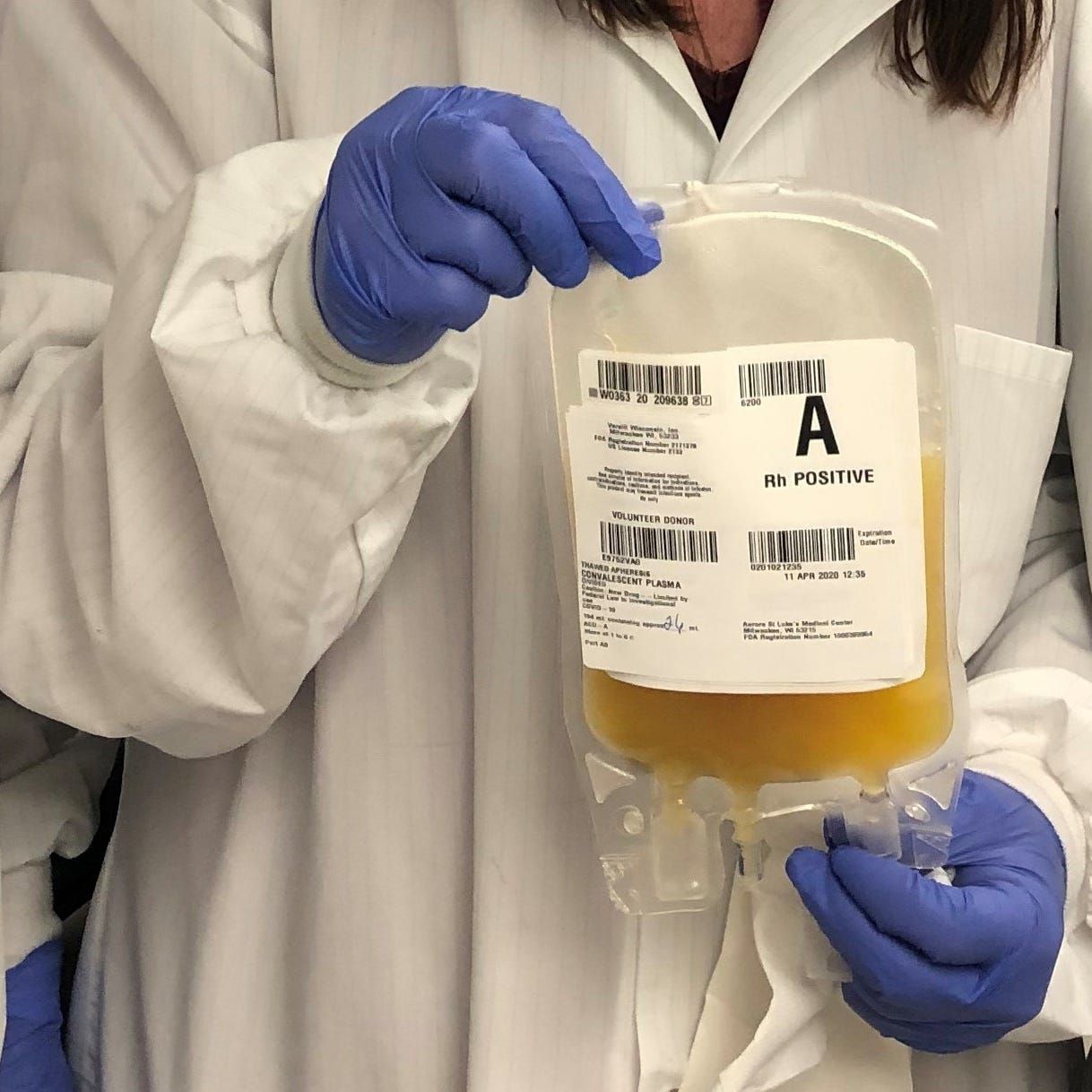
La FDA autorizó este domingo a utilizar esta terapia en el país, pero la Organización Mundial de la Salud menciona que los estudios hasta ahora son contradictorios y que se requiere más investigación.
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA, su sigla en inglés) autorizó este domingo el uso de plasma sanguíneo de pacientes que se han recuperado del Covid-19 como tratamiento para la enfermedad, un día después de que el presidente Donald Trump acusó a la agencia de impedir el lanzamiento de vacunas y terapias contra el coronavirus por razones políticas.
El anuncio de la FDA de una llamada “autorización de uso de emergencia” también se produce en vísperas de la Convención Nacional Republicana, donde Trump será nominado para dirigir su partido durante cuatro años más.
En una publicación en Twitter, Trump escribió que el Estado profundo “o quien sea” en la FDA estaba dificultándole a las farmacéuticas inscribir a personas en ensayos clínicos para probar vacunas y terapias contra el coronavirus.
“Obviamente, están esperando retrasar la respuesta hasta después del 3 de noviembre. Hay que concentrarse en la velocidad, y salvar vidas”, escribió Trump, etiquetando al comisionado de la FDA, Stephen Hahn, en el tuit.
La FDA declaró que la evidencia preliminar sugiere que el plasma sanguíneo puede disminuir la mortalidad y mejorar la salud de los pacientes cuando se administra en los primeros tres días de su hospitalización. No quedó claro de inmediato cuál sería el impacto inmediato de esta decisión.
La agencia también dijo que determinó que este era un enfoque seguro en un análisis de 20.000 pacientes que recibieron este tratamiento. Hasta ahora, 70.000 pacientes han sido tratados con plasma sanguíneo, precisó la FDA.
Los pacientes que más se beneficiaron de este tratamiento fueron los menores de 80 años que no usaban respirador artificial, dijo la agencia. Esos pacientes tenían una tasa de supervivencia un 35 por ciento mejor un mes después de recibir el tratamiento.
OMS cautelosa ante aprobación del plasma como tratamiento
La Organización Mundial de la Salud (OMS) se mostró cautelosa el lunes respecto a la aprobación del uso de plasma de pacientes recuperados de Covid-19 para tratar a personas enfermas.
El organismo dijo que la evidencia sobre la efectividad del tratamiento sigue siendo de “baja calidad”, incluso cuando Estados Unidos emitió una autorización de emergencia para este tipo de terapias.
“Hay una serie de ensayos clínicos en todo el mundo que analizan el plasma convaleciente en comparación con el estándar”, dijo Soumya Swaminathan, científico jefe de la OMS.
“Solo algunos de estos han informado resultados provisionales (...) y por el momento, todavía hay evidencia de muy baja calidad”, agregó en una conferencia de prensa.
El llamado “plasma convaleciente”, que se ha utilizado durante mucho tiempo para tratar enfermedades, se ha convertido en el último punto de atención política en la carrera por encontrar terapias para el Covid-19.
La OMS hace referencia a que la evidencia es contradictoria: un estudio chino mostró que el plasma de personas que se recuperaron del coronavirus no logró marcar una diferencia en los pacientes hospitalizados, mientras que otro análisis conjunto mostró que puede reducir el riesgo de muerte.
Un desafío, agregó Swaminathan, es la variabilidad del plasma, ya que se extrae de muchas personas diferentes, lo que genera un producto que está menos estandarizado que los anticuerpos monoclonales elaborados en el laboratorio.
Bruce Aylward, alto asesor de la Organización Mundial de la Salud, agregó que más allá de la eficacia del plasma, también existen riesgos potenciales de seguridad que deben ser examinados.
“Hay una serie de efectos secundarios”, dijo Aylward, que van desde fiebre leve hasta lesiones pulmonares graves o sobrecarga circulatoria. “Por esa razón, los resultados de los ensayos clínicos son extremadamente importantes”.










Comenta
Por favor, inicia sesión en La Tercera para acceder a los comentarios.